УТВЕРЖДЕНА
Приказом Председателя РГУ «Комитет медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан» от «31» декабря 2024 г.
№ N082535, N082534, N082533
Общая характеристика лекарственного препарата
1. Наименование лекарственного препарата
Юперио, таблетки, покрытые пленочной оболочкой, 50 мг, 100 мг и 200 мг
2. Качественный и количественный состав
2.1 Общее описание
Сакубитрил/валсартан тринатрия полупентагидрат
2.2 Качественный и количественный состав
Одна таблетка содержит
Сакубитрил/валсартан тринатрия полупентагидрат 56.551 мг, 113.103 мг или 226.206 мг (эквивалентно 50 мг, 100 мг или 200 мг сакубитрила/валсартана в виде кислоты безводной)
Полный список вспомогательных веществ см. в пункте 6.1.
3. Лекарственная форма
Таблетки, покрытые пленочной оболочкой.
Таблетки овальной формы, с двояковыпуклой поверхностью, покрытые оболочкой фиолетово-белого цвета, с фаской и гравировкой «NVR» на одной и «LZ» на другой стороне (для дозировки 50 мг).
Таблетки овальной формы, с двояковыпуклой поверхностью, покрытые оболочкой бледно-желтого цвета, с фаской и гравировкой «NVR» на одной и «L1» на другой стороне (для дозировки 100 мг).
Таблетки овальной формы, с двояковыпуклой поверхностью, покрытые оболочкой светло-розового цвета, с фаской и гравировкой «NVR» на одной и «L11» на другой стороне (для дозировки 200 мг).
4. Клинические данные
Лечение симптоматической хронической сердечной недостаточности у взрослых пациентов со сниженной фракцией выброса левого желудочка (см. раздел 5.1).
лечение симптоматической хронической сердечной недостаточности у детей и подростков в возрасте одного года и старше с систолической дисфункцией левого желудочка (см. раздел 5.1).
Препарат Юперио не следует назначать одновременно с ингибиторами ангиотензин-конвертирующего фермента (АКФ) или блокаторами рецепторов ангиотензина II (БРА). Ввиду потенциального риска развития ангионевротического отёка при одновременном применении с ингибитором АКФ, препарат не должен применяться, если с момента отмены ингибитора АКФ не прошло как минимум 36 часов (см. разделы 4.3, 4.4 и 4.5).
Валсартан, содержащийся в препарате Юперио, имеет более высокую биодоступность по сравнению с валсартаном, содержащимся в других таблетируемых лекарственных формах (см. раздел 5.2).
В случае пропуска дозы пациент должен принять следующую дозу по назначенному расписанию приема.
Сердечная недостаточность у взрослых
Рекомендуемая начальная доза препарата Юперио – по одной таблетке 100 мг два раза в сутки, за исключением ситуаций, описанных ниже. Доза должна быть увеличена вдвое на 2-4 неделе приема таким образом, чтобы целевая доза составляла одну таблетку 200 мг два раза в сутки при условии хорошей переносимости пациентом (см. раздел 5.1).
Если у пациентов развивается непереносимость (систолическое артериальное давление (САД) ≤95 мм рт.ст., симптоматическая гипотензия, гиперкалиемия, нарушение функции почек, рекомендуется скорректировать комбинированную терапию или временно снизить дозировку или прекратить терапию препаратом Юперио (см. раздел 4.4).
Во время исследования PARADIGM-HF препарат Юперио применялся в сочетании с другими препаратами для лечения сердечной недостаточности, вместо ингибитора ангиотензин-конвертирующего фермента (АКФ) или других блокаторов рецепторов ангиотензина II (БРА) (см. раздел 5.1). Информация о лечении пациентов, не принимающих ингибиторы АКФ или БРА, или принимающих их в низких дозах, ограничена. Поэтому для такой категории пациентов рекомендуемая начальная доза составляет 50 мг два раза в сутки с медленным повышением дозы (удваивание суточной дозы 1 раз в 3-4 недели) (см. «Титрование» в разделе 5.1).
Не рекомендуется начинать лечение у пациентов с уровнем сывороточного калия >5.4 ммоль/л или с САД <100 мм рт.ст. (см. раздел 4.4). Начальная доза 50 мг два раза в сутки рекомендуется для пациентов с САД ≥100 - 110 мм рт.ст.
Сердечная недостаточность у детей
В таблице 1 представлены рекомендованные дозы для детей. Рекомендованная доза должна приниматься внутрь два раза в сутки. Дозу следует увеличивать каждые 2–4 недели до достижения целевой дозы, переносимой пациентом. Юперио, таблетки, покрытые пленочной оболочкой, не подходят для детей с массой тела менее 40 кг. Для таких пациентов доступен препарат Юперио, гранулы, покрытые оболочкой.
Таблица 1. Титрование рекомендованной дозы 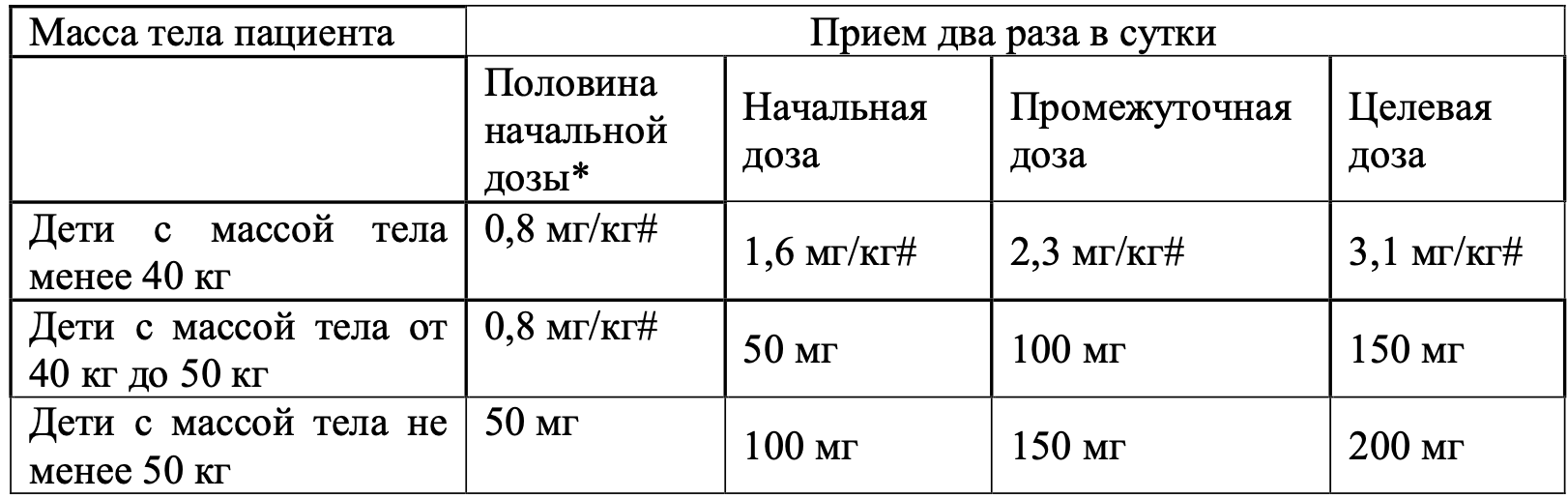
* Половина начальной дозы рекомендуется пациентам, которые не принимали ингибиторы АКФ или БРА или принимали низкие дозы этих препаратов, пациентам с нарушением функции почек (расчетная скорость клубочковой фильтрации [рСКФ] < 60 мл/мин/1,73 м2) и пациентам с умеренным нарушением функции печени (см. раздел «Особые группы пациентов»).
# Для доз 0,8 мг/кг, 1,6 мг/кг, 2,3 мг/кг и 3,1 мг/кг см. комбинированное количество сакубитрила и валсартана, при этом они принимаются в виде гранул.
Для пациентов, не принимающих в настоящее время ингибиторы АКФ или БРА или принимающих их в низких дозах, рекомендуется прием половины начальной дозы. Для детей с массой тела от 40 кг до менее 50 кг рекомендуется начальная доза 0,8 мг/кг два раза в сутки (в виде гранул). После начала приема дозу повышают до стандартной начальной дозы в соответствии с рекомендуемым титрованием, представленным в таблице 1, и корректируют каждые 3–4 недели.
Например, у ребенка с массой тела 25 кг, который ранее не принимал ингибиторы АКФ, прием следует начинать с половины стандартной начальной дозы, что соответствует 20 мг (25 кг × 0,8 мг/кг) два раза в сутки, в виде гранул. После округления до ближайшего числа целых капсул это соответствует 2 капсулам по 12.5 мг сакубитрила/валсартана два раза в сутки.
Не рекомендуется начинать лечение у пациентов с уровнем сывороточного калия > 5,3 ммоль/л или с САД < 5-го процентиля для возраста пациента. Если у пациентов развивается непереносимость (САД ≤ 5-го процентиля для возраста пациента, симптоматическая гипотензия, гиперкалиемия, нарушение функции почек), рекомендуется скорректировать комбинированную терапию или временно снизить дозировку или прекратить терапию препаратом Юперио (см. раздел 4.4).
Безопасность и эффективность Юперио у детей младше 1 года не установлена. Доступные в настоящий момент данные описаны в разделе 5.1, но нет никаких рекомендаций по дозировке препарата.
Пациенты пожилого возраста
Дозировка устанавливается с учетом функции почек пожилых пациентов.
Пациенты с нарушением функции печени
Для пациентов с нарушением функции печени легкой степени тяжести (классификация по системе Чайлд-Пью класс А) корректировка дозы препарата Юперио не требуется. Существует небольшой клинический опыт применения у пациентов с умеренным нарушением функции печени (классификация по системе Чайлд-Пью класс В) или с показателями аспартатаминотрансферазы (АСТ) / аланинаминотрансферазы (АЛТ) в два раза выше верхней границы нормы. Препарат Юперио должен применяться с осторожностью у данной категории пациентов; рекомендуется прием половины начальной дозы (см. разделы 4.4 и 5.2). Препарат Юперио противопоказан при тяжелой печеночной недостаточности, билиарном циррозе печени или холестазе (классификация по системе Чайлд-Пью класс С) (см. раздел 4.3).
Пациенты с нарушением функции почек
Для пациентов с нарушением функции почек легкой степени (расчетная скорость клубочковой фильтрации (рСКФ) 60-90 мл/мин/1.73 м2) корректировка дозы не требуется. Половина начальной дозы рекомендуется пациентам с умеренно выраженным нарушением функции почек (рСКФ 30-60 мл/мин/1.73 м2). Ввиду ограниченного клинического опыта применения препарата у пациентов с тяжелым нарушением функции почек (рСКФ <30 мл/мин/1.73 м2) (см. раздел 5.1) препарат Юперио рекомендуется назначать с осторожностью, в половине от начальной дозы. У детей с массой тела от 40 кг до менее 50 кг рекомендуется начальная доза 0,8 мг/кг два раза в сутки (в виде гранул). После начала приема дозу повышают в соответствии с рекомендуемым титрованием каждые 2–4 недели. Опыт применения препарата Юперио у пациентов с терминальной стадией болезни почек отсутствует, и прием препарата в данном случае не рекомендуется.
Перорально.
Время приема препарата Юперио не зависит от времени приема пищи (см. раздел 5.2). Таблетки следует проглотить и запить стаканом воды. Разделение или размельчение таблеток не рекомендуется.
- Гиперчувствительность к действующим веществам или к любому из вспомогательных веществ, перечисленных в разделе 6.1
- Одновременное применение с ингибиторами АКФ (см. разделы 4.4 и 4.5). Препарат Юперио нельзя принимать, если с момента отмены ингибитора АКФ не прошло 36 часов.
- Наличие в анамнезе ангионевротического отека на фоне предшествующего применения ингибиторов АКФ или БРА (см. раздел 4.4)
- Наследственный или идиопатический ангионевротический отек (см. раздел 4.4)
- Одновременное применение с лекарственными препаратами, содержащими алискирен у пациентов с сахарным диабетом или у пациентов с нарушением функции почек (рСКФ <60 мл/мин/1.73 м2) (см. разделы 4.4 и 4.5)
- Нарушения функции печени тяжелой степени, билиарный цирроз и холестаз (см. раздел 4.2)
- Второй и третий триместры беременности (см. раздел 4.6)
Комбинация сакубитрил/валсартан с ингибиторами АКФ противопоказана вследствие повышенного риска развития ангионевротического отека (см. раздел 4.3). Сакубитрил/валсартан нельзя принимать, пока с момента последнего приема дозы ингибитора АКФ не пройдет 36 часов. После прекращения терапии сакубитрил/валсартаном, прием ингибиторов АКФ не должен начинаться раньше, чем через 36 часов после приема последней дозы сакубитрил/валсартана (см. разделы 4.2, 4.3 и 4.5).
Не рекомендуется одновременно применять сакубитрил/валсартан с прямыми ингибиторами ренина, в частности, с алискиреном (см. раздел 4.5). Комбинация сакубитрил/валсартана с лекарственными препаратами, содержащими алискирен, противопоказана у пациентов с сахарным диабетом или с нарушением функции почек (рСКФ <60 мл/мин/1.73 м2) (см. разделы 4.3 и 4.5).
Препарат Юперио содержит валсартан, и, как следствие, не должен применяться с другими лекарственными препаратами, содержащими БРА (см. разделы 4.2 и 4.5).
Гипотензия
Лечение следует начинать, если САД составляет ≥100 мм рт.ст. Пациенты с САД ниже этих значений не исследовались (см. раздел 5.1). Сообщалось о случаях симптоматической гипотензии у пациентов, которые получали сакубитрил/валсартан во время клинических исследований (см. раздел 4.8), особенно, у пациентов ≥65 лет, пациентов с болезнью почек и пациентов с низким САД (<112 мм рт.ст.). На начальной стадии терапии или во время титрования дозы сакубитрил/валсартана артериальное давление должно контролироваться в плановом порядке. В случае развития гипотензии рекомендуется временно снизить дозу или прекратить терапию сакубитрил/валсартаном (см. раздел 4.2). Стоит учитывать необходимость в корректировке дозы диуретиков, сопутствующих антигипертензивных средств, а также принять во внимание другие причины гипотензии (например, гиповолемию). Вероятность возникновения симптоматической гипотензии, как правило, выше у пациентов с наличием гиповолемии, которая может быть вызвана одновременным применением диуретических средств, низкосолевой диеты, наличием диареи или рвоты. Пониженное содержание уровня натрия в крови и/или объема циркулирующей крови (ОЦК) должно быть устранено до начала терапии сакубитрил/валсартаном, при условии, что это не приведет к риску переизбытка ОЦК.
Нарушение функции почек
Обследование пациентов с сердечной недостаточностью всегда должно включать оценку функции почек. Пациенты с нарушением функции почек легкой и умеренной степени тяжести в более значительной степени подвержены риску развития гипотензии (см. раздел 4.2). Существует крайне ограниченный клинический опыт применения препарата у пациентов с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин/1.73м2), эти пациенты могут быть подвержены высокому риску развития гипотензии (см. раздел 4.2). Опыт применения сакубитрил/валсартана у пациентов с нарушением функции почек в терминальной стадии болезни почек отсутствует, применение препарата в данном случае не рекомендуется.
Ухудшение функции почек
Применение сакубитрил/валсартана может привести к ухудшению функции почек. Риск может в дальнейшем повыситься при дегидратации или одновременном применении нестероидных противовоспалительных препаратов (НПВП) (см. раздел 4.5). В случае клинически значимого ухудшения функции почек следует рассмотреть вопрос об уменьшении дозы препарата.
Гиперкалиемия
Лечение не следует начинать, если уровень сывороточного калия >5,4 ммоль/л у взрослых пациентов и > 5,3 ммоль/л у детей. Терапия препаратом Юперио может увеличить риск развития гиперкалиемии, при том, что гипокалиемия также может возникнуть (см. раздел 4.8). Рекомендуется регулярно контролировать уровень сывороточного калия, особенно у пациентов с такими факторами риска, как нарушение функции почек, сахарный диабет или гипоальдостеронизм, или диета с высоким содержанием калия, а также прием антагонистов минералокортикоидов (см. раздел 4.2). В случае развития клинически значимой гиперкалиемии рекомендуется коррекция дозы сопутствующих препаратов, либо временное снижение дозы или прекращение терапии. Рекомендуется рассмотреть прекращение терапии, если уровень сывороточного калия >5,4 ммоль/л.
Ангионевротический отек
На фоне применения сакубитрил/валсартана отмечались случаи развития ангионевротического отека. При возникновении ангионевротического отека препарат сакубитрил/валсартан следует немедленно отменить и назначить надлежащее лечение и наблюдение за пациентом до полного и стойкого разрешения всех возникших симптомов. Препарат не должен приниматься повторно. В случаях подтвержденного ангионевротического отека, при котором отек распространялся только на лицо и губы, данное состояние, как правило, разрешалось без вмешательства, хотя применение антигистаминных средств способствовало облегчению симптомов.
Ангионевротический отек, сопровождающийся отеком гортани, может привести к летальному исходу. В тех случаях, когда отек распространяется на язык, голосовые складки или гортань, что может привести к обструкции дыхательных путей, необходимо немедленно начать надлежащее лечение, например, введение раствора адреналина 1 мг/1 мл (0,3 - 0,5 мл), и/или обеспечить проходимость дыхательных путей.
Пациенты, которые имели в анамнезе ангионевротический отёк, не исследовались. Ввиду того, что они могут быть подвержены более высокому риску развития ангионевротического отека, рекомендуется назначать сакубитрил/валсартан данной категории пациентов с большой осторожностью. Сакубитрил/валсартан противопоказан пациентам, в анамнезе которых имеется ангионевротический отек на фоне применения ингибитора АКФ или БРА или наследственный, или идиопатический ангионевротический отек (см. раздел 4.3). Пациенты негроидной расы в большей степени подвержены риску развития ангионевротического отека (см. раздел 4.8).
Пациенты со стенозом почечной артерии
Сакубитрил/валсартан может вызывать повышение концентрации мочевины и креатинина в сыворотке крови у пациентов с односторонним или двусторонним стенозом почечных артерий. У пациентов со стенозом почечной артерии препарат следует применять с осторожностью, регулярно контролируя функцию почек.
Пациенты класса IV по функциональной классификации Нью-Йоркской ассоциации кардиологов (NYHA)
Необходимо соблюдать осторожность при применении сакубитрил/валсартана у пациентов с функциональным классом IV по NYHA, поскольку данные о клиническом применении у данной категории пациентов ограничены.
Натрийуретический пептид В-типа (BNP)
BNP не является должным биомаркером сердечной недостаточности у пациентов, которые получали сакубитрил/валсартан, т.к. он представляет собой субстрат неприлизина (см. раздел 5.1).
Пациенты с нарушением функции печени
Существует ограниченный опыт клинического применения препарата у пациентов с нарушениями функции печени умеренной степени тяжести (класс В по Чайлд-Пью) или со значениями АСТ/АЛТ, превышающими верхнюю границу нормы в два раза. Пациенты данной категории более подвержены воздействию препарата, и степень безопасности для них не установлена. Как следствие, необходимо с осторожностью назначать препарат данным пациентам (см. раздел 4.2 и 5.2). Сакубитрил/валсартан противопоказан пациентам с нарушением функции печени тяжелой степени, билиарным циррозом печени или холестазом (класс С по Чайлд-Пью) (см. раздел 4.3).
Нарушения психики
Психиатрические явления, такие как галлюцинации, паранойя и нарушения сна, в контексте психотических событий были связаны с применением препарата сакубитрил/валсартан. Если у пациента возникают такие явления, следует рассмотреть возможность прекращения лечения препаратом сакубитрил/валсартан.
Натрий
Препарат Юперио содержит менее 1 ммоль натрия (23 мг) на дозу 200 мг, т. е. является практически безнатриевым.
Одновременное применение сакубитрил/валсартана с ингибиторами АКФ противопоказано, поскольку одновременное ингибирование неприлизина (NEP) и АКФ повышает риск развития ангионевротического отека. Терапию сакубитрил/валсартаном необходимо начинать не ранее, чем через 36 часов после последней дозы приема ингибитора АКФ. Терапия ингибитором АКФ должна начинаться не раньше, чем через 36 часов после последней дозы сакубитрил/валсартана (см. разделы 4.2 и 4.3).
Алискирен
Одновременное применение сакубитрил/валсартана с алискирен-содержащими лекарственными препаратами противопоказано пациентам с сахарным диабетом и пациентам с нарушением функции почек (рСКФ <60 мл/мин/1.73 м2) (см. раздел 4.3). Комбинация сакубитрил/валсартана и прямых ингибиторов ренина, таких как алискирен, не рекомендуется (см. раздел 4.4). Комбинация сакубитрил/валсартана и алискирена потенциально связана с более высокой частотой побочных реакций, таких как гипотензия, гиперкалиемия и сниженная функция почек (включая острую почечную недостаточность) (см. разделы 4.3 и 4.4).
Взаимодействия, ведущие к нежелательному сочетанному применению
Препарат Юперио содержит валсартан, и, как следствие, не должен применяться с другими препаратами, содержащими БРА (см. раздел 4.4).
Взаимодействия, в отношении которых следует соблюдать меры предосторожности Субстраты OATP1B1 и OATP1B3, например, статины
Данные in vitro указывают на то, что сакубитрил ингибирует транспортеры OATP1B1 и OATP1B3. Как следствие, препарат Юперио может увеличить системную экспозицию субстратов OATP1В1 и OATP1B3, в частности статинов. Одновременное применение сакубитрил/валсартана увеличивало Сmax аторвастатина и его метаболитов в 2 раза и AUC в 1,3 раза. Таким образом, следует проявлять осторожность при одновременном применении сакубитрил/валсартана со статинами. При одновременном назначении симвастатина и препарата Юперио не наблюдалось клинически значимого взаимодействия между лекарственными средствами.
Ингибиторы фосфодиэстеразы 5, включая силденафил
У пациентов с гипертензией, получающих препарат Юперио (до достижения равновесной концентрации), применение однократной дозы силденафила более значительно усиливало антигипертензивное действие по сравнению с применением сакубитрил/валсартана в монотерапии. По этой причине у пациентов, получающих сакубитрил/валсартан, применять силденафил или другой ингибитор фосфодиэстеразы 5-го типа следует с осторожностью.
Калий
Одновременное применение калийсберегающих диуретиков (триамтерен, амилорид), антагонистов минералокортикоидов (например, спиронолактона, эплеренона), калиевых добавок, или калийсодержащих заменителей поваренной соли, или других препаратов (например, гепарина) может привести к повышению уровня калия в сыворотке и уровня сывороточного креатинина. У пациентов, получающих сакубитрил/валсартан одновременно с этими препаратами, рекомендуется регулярно контролировать содержание калия в сыворотке крови (см. раздел 4.4).
Нестероидные противовоспалительные препараты (НПВП), включая селективные ингибиторы циклооксигеназы-2 (ЦОГ-2)
У пожилых пациентов, пациентов с гиповолемией (включая тех, кто получает диуретики), или пациентов с нарушением почечной функции одновременное применение сакубитрил/валсартана и НПВП может привести к повышенному риску ухудшения функции почек.
В связи с этим у пациентов, получающих сакубитрил/валсартан одновременно с НПВП, при назначении подобной схемы лечения и в случае ее изменения рекомендуется контролировать функцию почек (см. раздел 4.4).
Препараты лития
Сообщалось об обратимом повышении концентраций лития в сыворотке и токсичности при одновременном применении лития и ингибиторов АКФ или антагонистов рецептора ангиотензина II, включая сакубитрил/валсартан. Следовательно, комбинация этих препаратов не рекомендуется. При необходимости применения этой комбинации требуется тщательный мониторинг уровня лития в сыворотке. При применении диуретиков риск токсического действия лития может возрастать.
Фуросемид
Одновременное применение сакубитрил/валсартана и фуросемида не влияет на фармакокинетику сакубитрил/валсартана, но сокращает Cmax и AUC фуросемида на 50% и 28% соответственно. В то время как объем мочи существенно не меняется, выделение натрия с мочой сокращалось в течение 4 и 24 часов после сочетанного применения. Средняя суточная доза фуросемида не менялась по сравнению с исходной дозой до конца исследования PARADIGM-HF у пациентов, получавших сакубитрил/валсартан.
Нитраты, например, нитроглицерин
Лекарственного взаимодействия между сакубитрил/валсартаном и нитроглицерином, вводимым внутривенно для понижения кровяного давления, не отмечено. Одновременное применение нитроглицерина и сакубитрил/валсартана сопровождалось разницей в частоте сердечных сокращений на 5 ударов в минуту по сравнению с применением только нитроглицерина. Аналогичный эффект на частоту сердечных сокращений может иметь место в случаях, когда сакубитрил/валсартан принимался с сублингвальными, пероральными или трансдермальными нитратами. В целом корректировка дозы не требуется.
Транспортеры ОATP и MRP2
Активный метаболит сакубитрила (LBQ657) и валсартан являются субстратами OATP1B1, OATP1B3, OAT1 и OAT3; валсартан – также субстрат MRP2. Таким образом, одновременное применение сакубитрил/валсартана с ингибиторами OATP1B1, OATP1B3, OAT3 (например, рифампицином, циклоспорином), OAT1 (например, тенофовиром, цидофовиром) или MRP2 (например, ритонавиром) может привести к повышению системной экспозиции LBQ657 или валсартана. Следует соблюдать осторожность в начале и при прекращении совместного применения препарата Юперио и данной группы препаратов.
Метформин
Одновременное применение сакубитрил/валсартана и метформина приводило к снижению Cmax и AUC метформина на 23%. Клиническая значимость этих данных неизвестна. Поэтому до начала лечения сакубитрил/валсартаном у пациентов, принимающих метформин, необходимо оценить их клиническое состояние.
Незначительные взаимодействия
Не наблюдалось клинически значимых лекарственных взаимодействий при одновременном применении препарата сакубитрил/валсартан с дигоксином, варфарином, гидрохлоротиазидом, амлодипином, омепразолом, карведилолом или в комбинации с левоноргестрелом/этинилэстрадиолом.
Не рекомендуется применять сакубитрил/валсартан во время первого триместра беременности. Препарат противопоказан к применению во время второго и третьего триместров беременности (см. раздел 4.3).
Валсартан
Эпидемиологические свидетельства в отношении риска тератогенности после воздействия ингибиторов АКФ во время первого триместра беременности не являются окончательными; тем не менее, нельзя исключать незначительное повышение риска. Несмотря на отсутствие контролируемых эпидемиологических данных в отношении риска тератогенности, связанного с БРА, похожие риски могут существовать для данного класса лекарственных препаратов. Кроме случаев, когда необходимо продолжать терапию БРА, пациенток, планирующих беременность, необходимо перевести на альтернативные антигипертензивные препараты, которые имеют проверенный профиль безопасности для применения во время беременности. Лечение препаратами БРА следует прекратить сразу после наступления беременности, и, если необходимо, назначается альтернативная терапия. Известно, что терапия БРА во время второго и третьего триместра провоцирует фетотоксичность (снижение функции почек, олигогидрамнион, замедление окостенения черепа) и неонатальную токсичность (почечная недостаточность, гипотензия, гиперкалиемия).
Если воздействие БРА произошло со второго триместра беременности, рекомендуется осуществлять ультразвуковое обследование почек и состояние костей черепа плода. Младенцев, матери которых принимали БРА, необходимо тщательно контролировать на предмет гипотензии (см. раздел 4.3).
Сакубитрил
Данные о применении сакубитрила у беременных женщин отсутствуют. Исследования на животных выявили репродуктивную токсичность (см. раздел 5.3).
Сакубитрил/валсартан
Данные о применении сакубитрил/валсартана у беременных женщин отсутствуют. Исследования на животных с применением сакубитрил/валсартана выявили репродуктивную токсичность (см. раздел 5.3).
Кормление грудью
Неизвестно, выделяется ли сакубитрил/валсартан с грудным молоком или нет. Компоненты препарата Юперио - сакубитрил и валсартан - выделялись с молоком у лактирующих крыс (см. раздел 5.3). Ввиду потенциального риска развития побочных реакций у новорожденных детей и младенцев, находящихся на грудном вскармливании, не рекомендуется применять препарат во время кормления грудью. Решение об отказе от грудного вскармливания или прекращении применения сакубитрил/валсартана на период грудного вскармливания принимается с учетом степени необходимости применения сакубитрил/валсартана для матери.
Репродуктивная функция
Данные о влиянии сакубитрил/валсартана на репродуктивную функцию человека отсутствуют. Во время исследований препарата на самцах и самках крыс не были выявлены нарушения репродуктивной функции (см. раздел 5.3).
Сакубитрил/валсартан оказывает незначительное влияние на способность управлять транспортными средствами и механизмами. В связи с возможным возникновением головокружения или повышенной утомляемости следует соблюдать осторожность при вождении автотранспорта или работе с механизмами.
Во время терапии сакубитрил/валсартаном наиболее часто сообщалось о таких побочных реакциях, как гипотензия (17,6 %), гиперкалиемия (11,6 %) и нарушение функции почек (10,1 %) (см. раздел 4.4). Имелись сообщения, что у пациентов, принимавших сакубитрил/валсартан, развивался ангионевротический отек (0,5%) (см. описание отдельных побочных реакций).
Определение частоты побочных явлений проводится в соответствии со следующими критериями: очень часто (≥1/10), часто (≥ от 1/100 до <1/10), нечасто (≥ от 1/1000 до <1/100), редко (≥1/10000 до <1/1000), очень редко (<1/10000). В каждой группе нежелательные реакции распределены по частоте возникновения в порядке убывания серьезности.
Таблица 1. Перечень нежелательных реакций

Сообщалось, что у пациентов, принимавших сакубитрил/валсартан, развивался ангионевротический отек. В исследовании PARADIGM-HF ангионевротический отек развился у 0,5% пациентов, получавших сакубитрил/валсартан, в сравнении с 0,2% пациентов, получавших эналаприл. Более высокая частота развития ангионевротического отека наблюдалась у пациентов негроидной расы, получавших сакубитрил/валсартан (2,4%) и эналаприл (0,5%) (см. раздел 4.4).
Гиперкалиемия и сывороточный калий
Во время исследования PARADIGM-HF гиперкалиемия и концентрации сывороточного калия >5,4 ммоль/л наблюдались у 11,6% и 19,7% пациентов, получавших сакубитрил/валсартан и у 14,0% и 21,1% пациентов, получавших эналаприл, соответственно.
Артериальное давление
Во время исследования PARADIGM-HF, гипотензия и клинически значимое низкое систолическое давление крови (<90 мм рт.ст. и понижение от исходных показателей >20 мм рт.ст.) были отмечены у 17,6% и 4,76% пациентов, получавших сакубитрил/валсартан, и у 11,9% и 2,67% пациентов, получавших эналаприл, соответственно.
Нарушение функции почек
Во время исследования PARADIGM-HF нарушение функции почек развивалась у 10,1% пациентов, получавших сакубитрил/валсартан и у 11,5% пациентов, получавших эналаприл.
Пациенты детского возраста
В исследовании PANORAMA-HF безопасность сакубитрила/валсартана оценивали в рандомизированном 52-недельном исследовании с контролем активным препаратом в 375 случаях сердечной недостаточности (СН) у детей в возрасте от 1 месяца до < 18 лет по сравнению с эналаприлом. Профиль безопасности, наблюдаемый у детей в возрасте от 1 месяца до < 18 лет, которые получали лечение сакубитрилом/валсартаном, был схожим с профилем безопасности, наблюдаемым у взрослых пациентов. Данные по безопасности применения в пациентов в возрасте от 1 месяца до < 1 года ограничены. Данные по безопасности применения у детей с нарушениями функции печени умеренной степени и нарушениями функции почек от умеренной до тяжелой степени ограничены.
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата (ЛП) с целью обеспечения непрерывного мониторинга соотношения «польза-риск» ЛП. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях ЛП через национальную систему сообщения о нежелательных реакциях РК.
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитет медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан http://www.ndda.kz
Данных о передозировке препаратом Юперио у человека недостаточно.
Однократное применение препарата в дозе 583 мг сакубитрила / 617 мг валсартана и многократное в дозе 437 мг сакубитрила / 463 мг валсартана (14 дней) у здоровых добровольцев в исследовании сопровождалось хорошей переносимостью.
Наиболее вероятным симптомом передозировки является гипотензия, обусловленная антигипертензивным действием сакубитрил/валсартана. В этом случае рекомендовано симптоматическое лечение. Вероятность выведения лекарственного препарата в ходе гемодиализа крайне мала вследствие высокого связывания с белками плазмы крови (см. раздел 5.2).
5. Фармакологические свойства
Препараты, влияющие на ренин-ангиотензиновую систему. Ангиотензина II антагонисты, комбинации. Ангиотензина II антагонисты, другие комбинации. Сакубитрил/валсартан.
Код ATХ C09DX04
Сакубитрил/валсартан демонстрирует механизм действия ингибитора ангиотензиновых рецепторов неприлизина посредством одновременного ингибирования неприлизина (нейтральная эндопептидаза; NEP) через LBQ657 – активный метаболит пропрепарата сакубитрила, и блокирования рецепторов ангиотензина II 1-го типа (AT1) валсартаном. Дополнительный положительный эффект препарата сакубитрил/валсартан на сердечно-сосудистую систему у пациентов с сердечной недостаточностью объясняется тем, что LBQ657 активирует пептиды, которые распадаются под воздействием неприлизина, в частности натрийуретические пептиды (НУП), в то время как валсартан ингибирует негативные эффекты ангиотензина II. НУП проявляют свой эффект за счет активации мембраносвязанных рецепторов, сопряженных с гуанилциклазой, что приводит к повышению концентрации вторичного мессенджера, циклического гуанозинмонофосфата (цГМФ), вызывающего симптомы вазодилатации, увеличение натрийуреза и диуреза, увеличение скорости клубочковой фильтрации и почечного кровотока, подавление высвобождения ренина и альдостерона, снижение симпатической активности, а также антигипертрофическое и антифибротическое действие.
Валсартан, избирательно блокируя рецепторы AT1, подавляет негативные эффекты ангиотензина II на сердечно-сосудистую систему и почки, а также блокирует ангиотензин II-зависимое высвобождение альдостерона. Это предотвращает стойкую активацию ренин-ангиотензин-альдостероновой системы (РААС), которая вызывает сужение сосудов, задержку натрия и воды почками, активацию роста и пролиферацию клеток, а также последующую перестройку сердечно-сосудистой системы, усугубляющей нарушения в ее функционировании.
Фармакодинамические эффекты сакубитрила/валсартана оценивали после его однократного и многократного применения у здоровых добровольцев, а также у пациентов с сердечной недостаточностью. Отмечающиеся эффекты соответствовали механизму действия комплекса действующих веществ, состоящем в одновременном подавлении неприлизина и блокаде РААС. В семидневном исследовании у пациентов со сниженной фракцией выброса (ФВ) левого желудочка, в котором валсартан применяли в качестве контроля, применение сакубитрила и валсартана приводило к статистически значимому кратковременному увеличению натрийуреза, увеличению концентрации цГМФ в моче и снижению концентрации предсердного натрийуретического пептида (MR-proANP) и N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) в плазме крови (по сравнению с валсартаном). В 21-дневном исследовании у пациентов со сниженной ФВ левого желудочка применение сакубитрил/валсартана вызывало статистически значимое увеличение концентрации предсердного натрийуретического пептида (ANP) и цГМФ в моче и концентрации цГМФ в плазме крови, а также снижение плазменных концентраций NT-proBNP, альдостерона и эндотелина-1 (по сравнению с исходным состоянием). Кроме того, применение сакубитрила/валсартана блокирует AT1-рецептор, на что указывает увеличение активности и концентрации ренина в плазме крови. В ходе исследования PARADIGM-HF комплекс сакубитрила и валсартана вызывал более выраженное снижение концентрации NT-proBNP в плазме крови и более значительное повышение концентраций мозгового натрийуретического пептида (BNP) и цГМФ в моче, чем эналаприл. В то время как BNP является субстратом неприлизина, NT-proBNP таковым не является. Поэтому NT-proBNP, в отличие от BNP, можно использовать в качестве биомаркера при мониторинге пациентов с сердечной недостаточностью, получающих комплекс сакубитрила и валсартана (см. раздел 4.4).
В исследовании с подробным изучением интервала QTc у здоровых добровольцев мужского пола однократное применение препарата Юперио в дозах 194 мг сакубитрила/206 мг валсартана и 583 мг сакубитрила/617 мг валсартана не оказывало эффекта на реполяризацию сердца.
Неприлизин – один из нескольких ферментов, участвующих в метаболизме амилоида-β (Aβ) головного мозга и спинномозговой жидкости (СМЖ). На фоне применения сакубитрил/валсартана в дозе 194 мг сакубитрил/206 мг валсартан один раз в сутки в течение двух недель у здоровых добровольцев концентрация Aβ 1-38 в СМЖ увеличивалась по сравнению с плацебо; при этом концентрация Aβ 1-40 и 1-42 в СМЖ никак не менялась. Клиническое значение этого факта неизвестно (см. раздел 5.3).
Дозировки - 24 мг/26 мг, 49 мг/51 мг и 97 мг/103 мг указываются в некоторых источниках как 50, 100 или 200 мг.
PARADIGM-HF – мультинациональное, рандомизированное, двойное-слепое опорное исследование фазы 3 при участии 8442 пациентов, в ходе которого сравнивались сакубитрил/валсартан и эналаприл, принимаемые взрослыми пациентами с хронической сердечной недостаточностью, II-IV класс по NYHA, и сниженной фракцией выброса (фракция выброса левого желудочка [ФВЛЖ] ≤40%, позднее скорректированная до ≤35%) дополнительно с другими препаратами, назначаемыми при сердечной недостаточности. Первичная конечная точка была комбинированной - смерть по причине сердечно-сосудистой патологии или госпитализация в связи с сердечной недостаточностью. Пациенты с САД <100 мм рт.ст., с нарушением функции почек тяжелой степени тяжести (рСКФ <30 мл/мин/1.73 м2) и с нарушением функции печени тяжелой степени были исключены из скрининга, и как следствие, не прошли проспективное исследование.
До включения в исследование пациенты получали лечение стандартными методами терапии, которые включали ингибиторы АКФ/БРА (>99%), бета-блокаторы (94%), антагонисты минералокортикоидов (58%) и диуретики (82%). Средний период наблюдения составил 27 месяцев, пациенты получали терапию до 4,3 лет.
От пациентов требовалось прекратить текущую терапию ингибиторами АКФ или БРА, после чего они включались в последовательный, простой слепой период ввода и получали эналаприл по 10 мг два раза в сутки, затем простую слепую терапию сакубитрил/валсартаном по 100 мг два раза в сутки, с повышением до 200 мг два раза в сутки (см. раздел 4.8 в отношении прекращения терапии во время данного периода). Затем их рандомизировали для участия в двойном слепом периоде исследования, в ходе которого они получали либо сакубитрил/валсартан по 200 мг, либо эналаприл по 10 мг два раза в сутки [сакубитрил/валсартан (n=4209); эналаприл (n=4233)].
Средний возраст исследуемой популяции – 64 года, при этом 19% были в возрасте 75 лет и старше. На момент рандомизации 70% пациентов имели II класс по NYHA, 24% пациентов - III класс и 0,7% - IV класс. Средний уровень ФВЛЖ составил 29%, 963 (11,4%) пациента имели исходный уровень ФВЛЖ >35% и ≤40%.
В группе сакубитрил/валсартан 76% пациентов остались на целевой дозе 200 мг два раза в сутки к концу исследования (средняя суточная доза - 375 мг). В группе эналаприла 75% пациентов остались на целевой дозе - 10 мг два раза в сутки к концу исследования (средняя суточная доза – 18,9 мг).
Сакубитрил/валсартан по сравнению с эналаприлом более значительно снижал риск летального исхода по причине сердечно-сосудистой патологии или госпитализации в связи с сердечной недостаточностью (21,8% в группе исследуемого препарата против 26,5% в группе эналаприла). Абсолютное снижение риска летального исхода по причине сердечно-сосудистой патологии или госпитализации в связи с сердечной недостаточностью составляло 4,7% (3,1% для риска летального исхода по причине сердечно-сосудистой патологии и 2,8% для первичной госпитализации в связи с сердечной недостаточностью). Относительное снижение риска по сравнению с эналаприлом составляло 20% (см. Таблицу 2). Эффект отмечен на ранних этапах применения препарата и сохранялся на протяжении всего периода исследования (см. рис. 1). Развитию эффекта способствовали оба действующих компонента препарата. Частота случаев внезапной смерти, которые составляли 45% всех летальных исходов по причине сердечно-сосудистой патологии, в группе сакубитрил/валсартан снизилась на 20% по сравнению с группой эналаприла (отношение рисков (hazard ratio, HR) 0,80, p=0,0082). Частота случаев развития недостаточности сократительной функции сердца, которая являлась причиной летального исхода в 26% случаев по причине сердечно-сосудистой патологии, в группе сакубитрил/валсартан снизилась на 21% по сравнению с таковым показателем в группе эналаприла (HR 0,79, p=0,0338).
Снижение данного риска стабильно наблюдалось в следующих подгруппах, включающих пол, возраст, расу, место проживания, класс по NYHA (II/III), фракцию выброса ЛЖ, почечную функцию, наличие в анамнезе диабета или гипертензии, терапию сердечной недостаточности и предсердную фибрилляцию.
Сакубитрил/валсартан увеличил выживаемость вместе со значительным снижением общей смертности на 2,8% (сакубитрил/валсартан, 17%, эналаприл, 19,8%). Снижение относительного риска составило 16% по сравнению с эналаприлом (см. таблицу 2).
Таблица 2. Эффект терапии для первичной комбинированной конечной точки, ее компонентов и смертности от всех причин на протяжении средней продолжительности наблюдения 27 месяцев
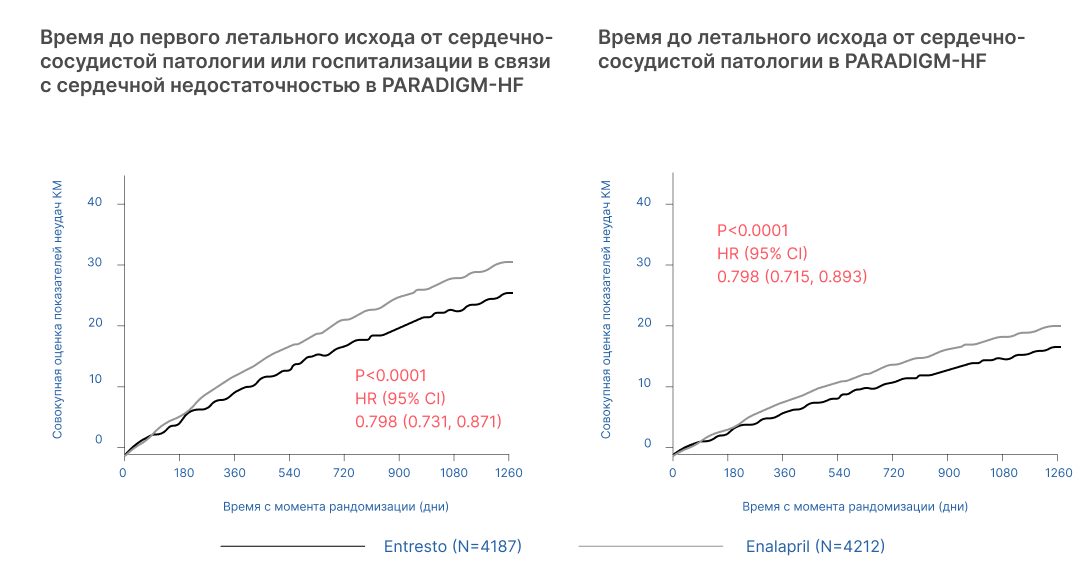
Рисунок 1. Кривые Каплана-Мейера (КМ) для первичной комбинированной конечной точки и компонента смерти от сердечно-сосудистой патологии 
TITRATION – это 12 недельное исследование оценки безопасности и переносимости у 538 пациентов с хронической сердечной недостаточностью (II—IV класс по NYHA) и систолической дисфункцией (фракция выброса левого желудочка <35%), которые ранее не получали ингибиторы АКФ или БРА или принимали ингибиторы АКФ или БРА в различных дозах перед включением пациентов в исследование. Пациенты сначала получали сакубитрил/валсартан по 50 мг два раза в сутки, затем доза была увеличена до 100 мг два раза в сутки, затем до целевой дозы - 200 мг два раза в сутки на протяжении 3- или 6-недельного режима.
Большее число пациентов, которые ранее не получали ингибиторы АКФ или БРА или получали низко-дозированную терапию (эквивалентно <10 мг эналаприла/сутки), достигли уровня дозирования сакубитрил/валсартан в 200 мг и оставались на данном уровне к моменту, когда дозировка увеличивалась на протяжении 6 недель (84.8%) по сравнению с 3 неделями (73.6%). В общем, 76% пациентов достигли и оставались на целевой дозе сакубитрила/валсартан - 200 мг два раза в сутки без перерыва в лечении или понижения дозы в течение 12 недель.
Валсартан, содержащийся в препарате Юперио, имеет более высокую биодоступность по сравнению с валсартаном, содержащимся в других таблетках; 26 мг, 51 мг, и 103 мг валсартана в препарате Юперио эквивалентны 40 мг, 80 мг и 160 мг валсартана в других таблетках, соответственно.
Абсорбция
После перорального применения препарат Юперио распадается на валсартан и неактивную форму (пролекарство) сакубитрил. Сакубитрил далее метаболизируется до активного метаболита LBQ657. Пиковые концентрации в плазме достигаются через 2 часа, 1 час и 2 часа, соответственно. Абсолютная биодоступность сакубитрила и валсартана при пероральном приеме превышает 60% и 23%, соответственно.
После применения сакубитрил/валсартана два раза в сутки равновесные концентрации сакубитрила, LBQ657 и валсартана достигаются в течение трех дней. Статистически значимого накопления сакубитрила и валсартана в равновесном состоянии не отмечается; в то же время накопление LBQ657 превышает концентрацию при однократном применении в 1,6 раза. Прием препарата во время еды не оказывает клинически значимого эффекта на показатели системного воздействия сакубитрила, LBQ657 и валсартана. Сакубитрил/валсартан можно принимать вне зависимости от приема пищи.
Распределение
Сакубитрил, LBQ657 и валсартан прочно связываются с белками плазмы (94-97%). Сравнение экспозиций в плазме крови и СМЖ показывает, что LBQ657 в небольшой степени проникает через гематоэнцефалический барьер (0,28%). Средний кажущийся объем распределения валсартана и сакубитрила составил от 75 до 103 литра, соответственно.
Биотрансформация
Сакубитрил быстро трансформируется в LBQ657 под воздействием карбоксилэстеразы lb и lc; далее LBQ657 существенно не метаболизируется. Валсартан метаболизируется в незначительной степени, в виде метаболитов обнаруживается лишь около 20% от введенной дозы. В плазме крови в незначительных концентрациях (<10%) обнаруживался гидроксильный метаболит.
Поскольку и сакубитрил, и валсартан в минимальной степени метаболизируются при участии изоферментов цитохрома CYP450, изменение их фармакокинетики в случае одновременного применения препаратов, влияющих на изоферменты CYP450, представляется маловероятным.
Исследования метаболизма in vitro показывают, что потенциал лекарственных взаимодействий на основе CYP450 невелик, поскольку метаболизм сакубитрил/ валсартана с помощью ферментов CYP450 ограничен. Сакубитрил/валсартан не индуцирует и не ингибирует ферменты CYP450.
Элиминация
После перорального применения 52-68% сакубитрила (преимущественно в качестве LBQ657) и ~13% валсартана и его метаболитов выводятся с мочой; 37-48% сакубитрила (преимущественно в качестве LBQ657) и 86% валсартана и его метаболитов выводятся с калом.
Сакубитрил, LBQ657 и валсартан выводятся из плазмы со средним периодом полувыведения (Т1/2) примерно 1,43 ч, 11,48 ч, и 9,90 ч, соответственно.
Линейность/ нелинейность
Фармакокинетика сакубитрила, LBQ657 и валсартана была примерно линейной во всем диапазоне доз сакубитрил/валсартана - от 24 мг сакубитрила/26 мг валсартана до 97 мг сакубитрила/103 мг валсартана.
Экспозиции LBQ657 и валсартана у категории пациентов старше 65 лет выше на 42% и 30% соответственно, чем у пациентов более молодого возраста.
Нарушение функции почек
Наблюдалась корреляция между почечной функцией и системным воздействием LBQ657 у пациентов с легкой или тяжелой формой нарушения функции почек. Воздействие LBQ657 у пациентов со средней (30 мл/мин/1.73 м2 ≤ рСКФ <60 мл/мин/1.73 м2) и тяжелой формой нарушения (15 мл/мин/1.73 м2 ≤ рСКФ <30 мл/мин/1.73 м2) было на 1.4 и 2.2 раза выше по сравнению с пациентами с легкой формой нарушения функции почек (60 мл/мин/1.73 м2 ≤ рСКФ <90 мл/мин/1.73 м2) - это самая большая группа пациентов, участвовавших в исследовании PARADIGM-HF). Воздействие валсартана было одинаковым у пациентов со средней и тяжелой формами нарушения функции почек по сравнению с пациентами с легкой формой. Исследования с участием пациентов, находящихся на гемодиализе, не проводились. Однако LBQ657 и валсартан в значительной степени связываются с белками плазмы, и как следствие, их выведение во время гемодиализа маловероятно.
Нарушение функции печени
У пациентов с нарушениями функции печени легкой и средней степеней тяжести экспозиция сакубитрила увеличивалась в 1.5 и 3.4 раза, LBQ657 – в 1.5 и 1.9 раза, и валсартана – в 1.2 и 2.1 раза, соответственно, по сравнению со здоровыми добровольцами. Однако у пациентов с нарушениями функции печени легкой или средней степени тяжести воздействие свободных концентраций LBQ657 увеличилось в 1.47 и 3.08 раза, соответственно, а воздействие свободных концентраций валсартана увеличилось в 1.09 и 2.20 раза, соответственно, по сравнению со здоровыми добровольцами. Сакубитрил/валсартан не исследовался у пациентов с нарушениями функции печени тяжелой степени, билиарным циррозом печени или холестазом (см. разделы 4.3 и 4.4)
Влияние пола
Фармакокинетика сакубитрил/валсартан (сакубитрил, LBQ657 и валсартан) была одинаковой у мужчин и женщин.
Данные доклинических исследований (включая исследования с составляющими сакубитрила и валсартана и/или сакубитрил/валсартана) не выявляют каких-либо особых рисков для человека на основании обычных исследований фармакологической безопасности, токсичности многократных доз, генотоксичности, канцерогенного потенциала и репродуктивной функции.
Репродуктивная функция и развитие плода
Терапия сакубитрил/валсартаном во время органогенеза привела к увеличению эмбриофетальных летальных исходов у крыс при дозах ≥49 мг сакубитрила/51 мг валсартана/кг/сутки (<0,72 раза для максимальной рекомендованной человеку дозы [MRHD] на основании AUC) и у кроликов при дозах ≥4,9 мг сакубитрила/5,1 мг валсартана/кг/сутки (в 2 раза и 0,03 раза для MRHD на основании AUC валсартана и LBQ657 соответственно). Препарат является тератогенным на основании низкой частоты проявления фетальной гидроцефалии на фоне токсичных доз для самок, которая наблюдалась у кроликов, получавших сакубитрил/валсартан >4,9 мг сакубитрила/5,1 мг валсартана/кг/сутки. Сердечно-сосудистые аномалии (преимущественно кардиомегалия) наблюдались у эмбрионов кроликов при дозах, не токсичных для самок (1,46 мг сакубитрила/1,54 мг валсартана/кг/сутки). Было отмечено небольшое увеличение двух вариаций скелета плода (деформация грудины, двустороннее окостенение грудины) у кроликов, получавших сакубитрил/валсартан: 4,9 мг сакубитрила/5,1 мг валсартана/кг/сутки. Побочные эмбриофетальные эффекты сакубитрил/валсартана объясняются активностью антагониста рецепторов ангиотензина (см. раздел 4.6).
Терапия сакубитрилом во время органогенеза привела к эмбриофетальной смертности и эмбриофетальной токсичности (низкий вес плода и деформации костей) у кроликов при дозах, вызывающих токсичность у самок (500 мг/кг/сутки; в 5,7 раз больше для MRHD на основании LBQ657 AUC). Легкая общая задержка окостенения наблюдалась при дозах >50 мг/кг/сутки. Данный факт не считается неблагоприятным. Доказательства эмбриофетальной токсичности или тератогенности у крыс, получавших сакубитрил, не найдены. Эмбриофетальная доза без наблюдаемых нежелательных эффектов (NOAEL) для сакубитрила составляла минимум 750 мг/кг/сутки у крыс и 200 мг/кг/сутки у кроликов (в 2,2 раза больше для MRHD на основании AUC LBQ657).
Исследования пренатального и постнатального развития у крыс на фоне применения сакубитрила в высоких дозах до 750 мг/кг/сутки (в 2,2 раза больше MRHD на основании AUC) и валсартана в дозах до 600 мг/кг/сутки (в 0,86 раза больше MRHD на основании AUC) указывают на то, что терапия сакубитрил/валсартаном во время органогенеза, беременности и лактации может повлиять на развитие и выживаемость новорожденных.
Действие сакубитрил/валсартана на концентрации амилоида-ẞ в спинномозговой жидкости и тканях головного мозга оценивалось на молодых (2-4 года) яванских макаках, которые получали сакубитрил/валсартан (24 мг сакубитрила/26 мг валсартана/кг/сутки) в течение двух недель. В данном исследовании клиренс Aβ ликвора у яванских макак снизился, в то время как уровни Aβ ликвора 1-40, 1-42 и 1-38 выросли. Повышение уровня Aβ в головном мозге не было отмечено. Уровень ликвора Aβ1-40 и 1-42 не повышался во время двухнедельного исследования на здоровых добровольцах (см. раздел 5.1). Более того, в исследовании токсикологии у макак, получавших сакубитрил/валсартан с 146 мг сакубитрила/154 мг валсартана/кг/сутки в течение 39 недель, доказательства наличия амилоидных бляшек в головном мозге не были найдены. Несмотря на это, количественное содержание амилоида не измерялось во время данного исследования.
Сакубитрил
У молодых крыс, получавших сакубитрил (7-70 дней постнатального периода) наблюдалось замедление развития костной массы и удлинения костей. Исследование у взрослых крыс выявило только минимальный преходящий ингибиторный эффект на костную минеральную плотность, но не на любые другие параметры, важные для роста кости, позволяющее предполагать, что сакубитрил не влияет на кости у взрослой популяции при нормальных условиях. Однако нельзя исключать небольшое преходящее влияние сакубитрила на ранней стадии сращения перелома у взрослых особей.
Валсартан
У молодых крыс, получавших валсартан (7-70 дней постнатального периода), дозы 1 мг/кг/сутки приводили к необратимым изменениям в почках, представленным трубчатой нефропатией (иногда сопровождающейся некрозом трубчатого эпителия) и расширением почечной лоханки. Данные изменения в почках представляют собой ожидаемый расширенный фармакологический эффект ингибиторов АКФ и блокаторов ангиотензина II 1-го типа; такие эффекты проявлялись, когда крысы получали препарат в течение первых 13 дней жизни. Данный период совпадал с 36 неделями беременности у людей, который может длиться до 44 недель после зачатия.
6. Фармацевтические свойства
Целлюлоза микрокристаллическая
Гидроксипропилцеллюлоза низкозамещенная
Кросповидон
Магния стеарат
Тальк
Кремния диоксид коллоидный безводный
состав оболочки:
Гипромеллоза
Титана диоксид (Е171)
Макрогол 4000/полиэтиленгликоль 4000
Тальк
Железа оксид красный (Е 172)
Железа оксид черный (Е 172) (для дозировок 50 мг и 200 мг)
Железа оксид желтый (Е 172) (для дозировки 100 мг).
Не применимо
3 года
Не применять по истечении срока годности.
Хранить в оригинальной упаковке при температуре не выше 30оС.
Хранить в защищенном от влаги месте.
Хранить в недоступном для детей месте!
По 14 таблеток помещают в контурную ячейковую упаковку из пленки ПВХ/ПВДХ и фольги алюминиевой печатной лакированной.
По 2 контурные упаковки вместе с инструкцией по медицинскому применению на казахском и русском языках вкладывают в картонную пачку.
Не применимо
По рецепту.
7. Держатель регистрационного удостоверения
Новартис Оверсиз Инвестментс АГ
Лихтштрассе 35, 4056 Базель, Швейцария
тел.: +7 (727) 258-24-47
e-mail: [email protected]
Претензии потребителей направлять по адресу:
Филиал Компании «Новартис Фарма Сервисэз АГ» в Республике Казахстан
050022 г. Алматы, ул. Курмангазы, дом 95
тел.: +7 (727) 258-24-47
e-mail: [email protected]
8. Номера регистрационных удостоверений
РК-ЛС-5№023194
РК-ЛС-5№023195
РК-ЛС-5№023196
9. Дата первичной регистрации (подтверждения регистрации, перерегистрации)
Дата первой регистрации: 21 августа 2017 г.
10. Дата пересмотра текста
Общая характеристика лекарственного препарата доступна на официальном сайте http://www.ndda.kz