
Информация о раке молочной железы
Информация о раке молочной железы
Рак молочной железы (РМЖ) является одним из самых распространенных онкологических заболеваний среди женщин во всем мире, а также и в Казахстане. В большинстве случаев РМЖ поражает железистые клетки протоков или долек молочной железы. На ранних стадиях обычно у пациенток имеется бессимптомное объемное образование, которое обнаруживается при осмотре или скрининговой маммографии1.
Факторы риска развития рака молочной железы
По данным Всемирной организации здравоохранения (ВОЗ) и Международного агентства по изучению рака (МАИР), в 2022 г. было зафиксировано 2 296 840 новых случаев рака молочной железы (РМЖ) и 666 103 смертей от этого заболевания. В мире РМЖ по-прежнему остается самым часто диагностируемым онкологическим заболеванием у женщин (23,8%, т. е. каждый 4 диагноз онкологического заболевания у женщин — это РМЖ) и самой частой причиной смерти среди женского населения2.

Иллюстрация: наиболее часто диагностируемые типы рака у женщин в мире
Факторы риска развития рака молочной железы
Факторы риска РМЖ делятся на две большие группы: основные и второстепенные.
К основным факторам риска относят:
Мутации генов BRCA1/BRCA2, p53, pTEN, CHEK 2. Мутации генов BRCA1/BRCA2 обусловливают развитие рака молочной железы у 5–10% женщин. Эти мутации встречаются достаточно редко в общей популяции (< 1%), и гораздо чаще среди определенных этнических групп (например, евреев-ашкенази)3,4
Наличие РМЖ у одного из родственников 1-й линии (матери, сестры, дочери) повышает риск его развития в 2 раза, и в 3–4 раза при наличии заболевания у двух и более родственников 1-й линии5
Риск РМЖ повышается при раннем менархе, первой беременности и родах в возрасте старше 30 лет, а также при наличии большого количества абортов в анамнезе
Доброкачественные изменения, такие как сложная фиброаденома, умеренная или выраженная гиперплазия ткани молочной железы (с атипией или без), склерозирующий аденоз или папиллома, могут незначительно увеличивать риск развития инвазивного рака молочной железы

К второстепенным факторам риска относят:
Риск РМЖ во много раз увеличивается при многократных попытках ЭКО, при подготовке к которому женщина получает высокие дозы эстрогенов
Наличие онкологических заболеваний со стороны других органов (рак яичников, эндометрия)
Употребление большого количества жирных кислот
Различают следующие клинические формы рака молочной железы: узловую, диффузную, а также рак Педжета (рак соска молочной железы).
Узловая форма РМЖ встречается наиболее часто (в 75–80% случаев). Клиническим проявлением узловой формы является наличиеузлового образования в ткани молочной железы6. При этом наиболее часто поражается наружный верхнийквадрант молочной железы.
Клинические проявления РМЖ разнообразны и зависят от стадии заболевания. Условно их можно разделить на ранние и поздние симптомы РМЖ6.
Наличие узла плотной консистенции в ткани молочной железы
Ограниченная подвижность узла, симптом «умбиликации», или втяжения кожи, над опухолью
Наличие одиночного плотного лимфатического узла в подмышечной области либо нескольких спаянных между собой узлов
При поражении протоков возможны кровянистые выделения из соска
Фиксация опухоли к грудной клетке или к вышерасположенной коже
Узелки или язвы на коже
Приподнятость над поверхностью кожи в результате отека
Диффузная форма РМЖчаще встречается у женщин более молодого возраста и отличается высокой агрессивностью излокачественностью6.
Клинические проявления рака Педжетазаключаются в образовании корочек в области соска, выделениях из соска, его покраснении и утолщении.На более поздних стадиях процесс может распространяться по крупным млечным протокам, с формированиемопухолевых узлов6.
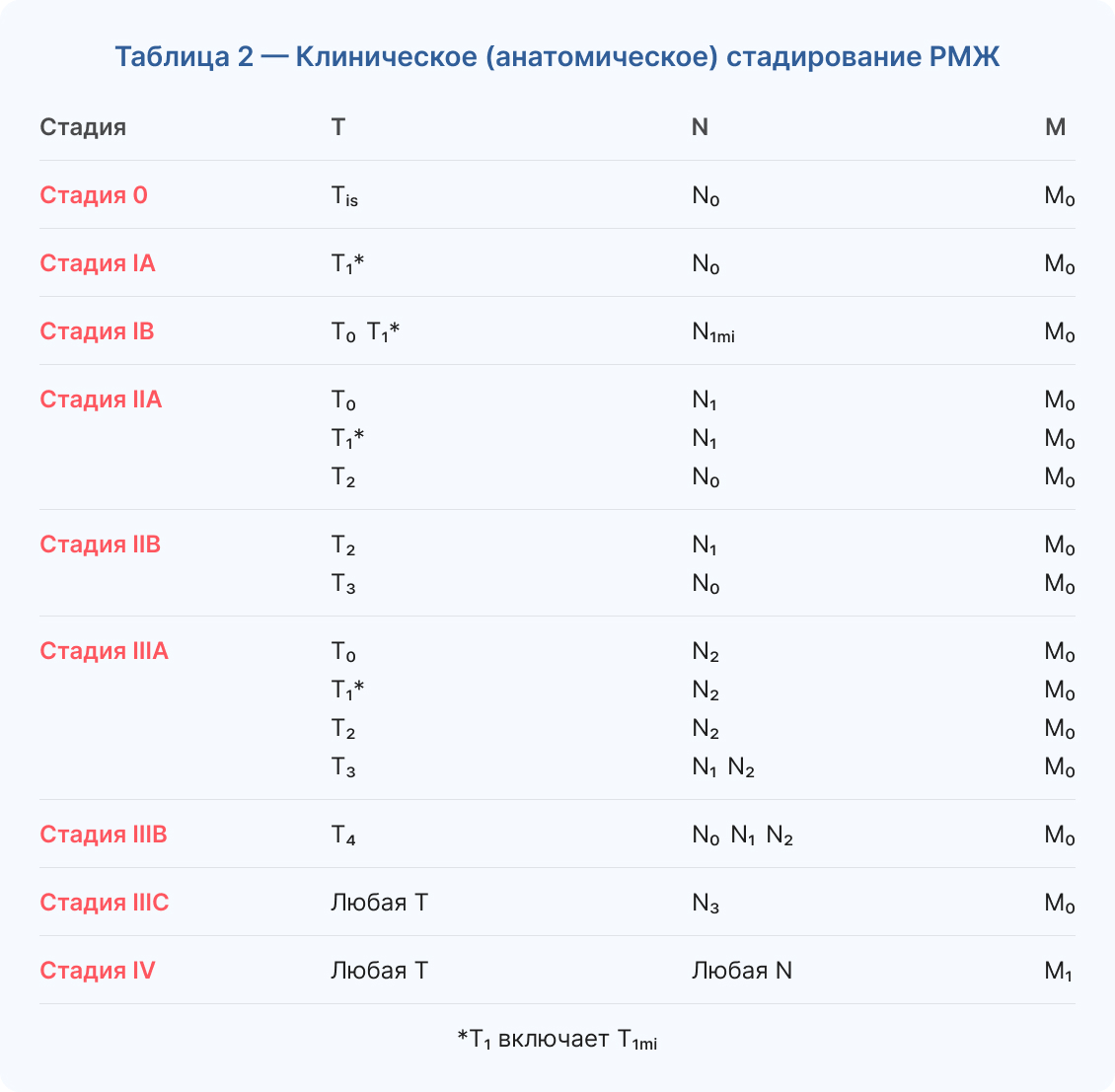
Для стадирования РМЖ следует использовать TNM-классификацию Американского противоракового комитета (AJCC) (8th ed, 2021)7.
Клиническое стадирование проводят на основании результатов клинического обследования8.
Т — первичная опухоль;
Тx — недостаточно данных для оценки опухоли;
Тis (DCIS) — протоковый рак in situ;
Тis (LCIS) — дольковый рак in situ;
Тis (Paget) — рак Педжета (соска) без признаков опухоли (при наличии опухоли оценку проводят по ее размеру);
Т1mic — микроинвазияа 0,1 см в наибольшем измерении.
Т1а — опухоль от 0,1 см до 0,5 см в наибольшем измерении;
Т1b — опухоль от 0,5 см до 1 см в наибольшем измерении;
Т1c — опухоль от 1 см до 2 см в наибольшем измерении;
Т2 — опухоль от 2 см до 5 см в наибольшем измерении;
Т3 — опухоль более 5 см в наибольшем измерении;
Т4 — опухоль любого размера с прямым распространением на грудную стенкуb или кожу;
Т4а — прорастание грудной стенки;
Т4b — отек (включая «лимонную корочку») или изъязвление кожи молочной железы либо сателлиты в кожежелезы;
Т4c — признаки, перечисленные в пунктах Т4a и Т4b;
Т4d — воспалительный (отечный) ракc;
N — регионарные лимфатические узлы;
Nx — недостаточно данных для оценки поражения регионарных лимфатических узлов;
N0 — нет признаков поражения метастазами регионарных лимфатических узлов;
N1 — метастазы в смещаемых подмышечных лимфатических узлах (на стороне поражения);
N2 — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой илификсированные, либо клинически определяемые метастазы во внутригрудных лимфатических узлах приотсутствии клинически явного поражения подмышечных лимфатических узлов;
N2a — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой илификсированные;
N2b — клинически определяемые метастазы во внутригрудных лимфатических узлах при отсутствииклинически явного поражения подмышечных лимфатических узлов;
N3 — метастазы в подключичных лимфатических узлах на стороне поражения, либо клиническиопределяемые метастазы во внутригрудных лимфатических узлах при наличии клинически явногопоражения подмышечных лимфатических узлов, либо метастазы в надключичных лимфатических узлах настороне поражения (независимо от состояния подмышечных и внутригрудных лимфатических узлов);
N3a — метастазы в подключичных лимфатических узлах на стороне поражения;
N3b — метастазы во внутригрудных лимфатических узлах при наличии клинически явного пораженияподмышечных лимфатических узлов;
N3c — метастазы в надключичных лимфатических узлах на стороне поражения;
M — отдаленные метастазы;
Mx — недостаточно данных для определения отдаленных метастазов;
M0 — нет признаков отдаленных метастазов;
M1 — имеются отдаленные метастазыd.
pT — первичная опухоль:
для патологоанатомической классификации необходимо исследование первичной опухоли; по краю производимой резекции не должно быть опухолевой ткани;
если по краю резекции имеется лишь микроскопическое распространение опухолевой ткани, то случай может классифицироваться как рТ;
при классификации рТ обязательно измеряют инвазивный компонент;
pN — регионарные лимфатические узлы.
Для определения патологоанатомической классификации необходимо выполнение подмышечной лимфаденэктомии (уровень I). В подобном эксцизионном материале обычно около 6 лимфатических узлов. Для уточнения патоморфологической классификации исследуют один или несколько сторожевых лимфатических узлов. Если классификация основывается только на данных биопсии сторожевых лимфатических узлов (БСЛУ) без дополнительного исследования подмышечных лимфатических узлов, то она кодируется (sn), например, рN1(sn);
рNx — недостаточно данных (не найдено лимфатических узлов, не удалены);
рN0 — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическомисследовании, дополнительные методы определения изолированных опухолевых клеток непроводились;
рN0(1-) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом ииммуногистохимических (ИГХ) исследованиях;
рN0(1+) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическомисследовании;
рN1 — микрометастазы или метастазы в 1–3 подмышечных лимфатических узлах и/или микроскопическоепоражение внутригрудных лимфатических узлов, выявленное по методике исследования (клинически неопределяемых) «сторожевых» лимфатических узлов;
рN1miс — микрометастазы (более 0,2 мм, но менее 2,0 мм);
рN1a — метастазы в 1–3 подмышечных лимфатических узлах, один из которых более 2 мм в наибольшемизмерении;
рN1b — микроскопическое поражение внутригрудных лимфатических узлов, выявленное по методикеисследования (клинически не определяемых) «сторожевых» лимфатических узлов;
рN2 — метастазы в 4–9 подмышечных лимфатических узлах или клинически определяемое поражениевнутригрудных лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов;
рN2a — метастазы в 4–9 подмышечных лимфатических узлах (как минимум одно скопление ≥ 2 мм);
рN2b — клинически определяемое поражение внутригрудных лимфатических узлов при отсутствии пораженияподмышечных лимфатических узлов;
рN3 — метастазы в 10 и более подмышечных лимфатических узлах или подключичных лимфатических узлах,или клинически определяемое поражение внутригрудных и подмышечных лимфатических узлов, илипоражение 4 и более подмышечных лимфатических узлов с микроскопическим поражением клиническиинтактных внутригрудных лимфатических узлов, либо поражение надключичных лимфатическихузлов;
рN3a — метастазы в 10 и более подмышечных лимфатических узлах (> 2 мм) или в подключичныхлимфатических узлах;
рN3b — клинически определяемое поражение внутригрудных и подмышечных лимфатических узлов, илипоражение более 3 подмышечных лимфатических узлов с микроскопическим поражением клиническиинтактных внутригрудных лимфатических узлов;
рN3c — метастазы в надключичных лимфатических узлах на стороне поражения;
рM — отдаленные метастазы;
рM — категории, соответствующие категории М;
G — степень дифференцировки ткани опухоли;
Gx — степень дифференцировки нельзя установить;
G1 — высокая степень дифференцировки ткани;
G2 — умеренная степень дифференцировки ткани;
G3 — низкая степень дифференцировки ткани;
G4 — недифференцированная опухоль;
ypT — состояние первичной опухоли после лекарственного лечения;
ypN — состояние регионарных лимфатических узлов после лекарственного лечения;
ypN — после лечения должно быть оценено так же, как и до лечения (клинически N).
Обозначение (sn) используют в том случае, если оценка «сторожевого» узла была проведена после лечения. Рубрикацию Х (ypNХ) нужно использовать, если не была выполнена оценка ypN после лечения (sn) или диссекции подмышечных лимфатических узлов.
Категория N аналогична тем, которые используют для рN.
а Микроинвазия— распространение опухолевых клеток через базальную мембрану в прилежащие ткани фокусом не более 0,1см в наибольшем измерении. При наличии множественных фокусов классификацию проводят по наибольшемуизмерению. Нельзя использовать сумму размеров фокусов. Наличие множественных фокусов должно бытьотмечено так же, как это делается при множественных инвазивных карциномах.
b Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но без грудных мышц.
c Воспалительная форма РМЖ характеризуется диффузным утолщением кожи с плотными краями, обычно без подлежащей пальпируемой массы. Если биопсия кожи отрицательна и нет локализованной опухолевой массы, при патологической классификации употребляют категорию рТх, а при клинической — Т4d. При оценке категории рТ определяют инвазивный компонент. Втяжение кожи, ретракция соска или другие кожные изменения, за исключением относящихся к Т4b и Т4d, могут оцениваться как Т1, Т2 и Т3, не влияя на стадирование.
d Легкое — pul, кости — oss, печень — hep, плевра — ple, брюшина — per, костный мозг — mar, головной мозг — bra, кожа — ski, надпочечники — adr, лимфатические узлы — lym, другие — оth.
Всем женщинам в возрасте старше 40 лет необходимо проходить обследования на выявление рака молочной железы8. Скрининговые методы включают:
Маммографию (в том числе цифровую и 3-мерную)
Клиническое обследование молочных желез практикующими клиницистами
Ежемесячное самостоятельное обследование молочных желез
МРТ (для пациентов с высоким уровнем риска)
Маммография более результативна у женщин в более старшем возрасте. В этом возрасте железистая ткань железы постепенно замещается жировой, и на ее фоне легче заметить патологические разрастания9.
Как правило, скрининг рекомендуется начинать в возрасте 40, 45, 50 лет и повторять ежегодно или каждые 2 года до 75 лет. Врачам следует убедиться, что пациенты понимают степень их индивидуального риска развития рака молочной железы, а также должны уточнить у пациентов их предпочтения по поводу обследования9.
Применение томосинтеза молочной железы(3-мерная маммография) с цифровой маммографией незначительно увеличивает частоту выявления рака иснижает скорость визуализации изображения10. Этот метод диагностики более эффективен у женщин сплотной тканью молочной железы. Более того, этот тест подвергает женщин почти в два раза большейдозе радиации по сравнению с традиционной маммографией.
Спорным остается вопрос о значении рутинного клинического обследования или самостоятельного обследования молочных желез. Американская коллегия акушеров и гинекологов рассматривает проведение клинического обследования и самообследования молочных желез в качестве важных составляющих скринингового обследования на рак молочной железы12.
Клиническое обследование молочных железобычно является частью обычного ежегодного обследования женщин в возрасте > 40 лет12.
Самообследование молочных желез само по себе не уменьшает смертность, данные о его эффективности противоречивы. Тем не менее онодостаточно широко применяется на практике. Самообследование следует рекомендовать проводитьпациенткам в один и тот же день. Для менструирующих женщин рекомендуется подождать 2 или 3 дня послеокончания менструации, чтобы молочные железы стали менее болезненными и припухшими. При обнаружениикаких-либо изменений поверхности кожи, формы или консистенции молочной железы необходимо сразу жеобратиться к специалисту.
Проведение МРТ считается более целесообразным, чем проведение самообследования или маммографии у женщин 30 лет с высоким риском развития рака ( > 20%) молочной железы, в частности имеющих мутацию гена BRCA. Для этих женщин обследование должно включать МРТ, а также маммографию и клиническое обследование молочных желез. Женщинам со средним риском развития РМЖ (15–20%) следует обсудить все преимущества и риски МРТ со своим врачом. МРТ не рекомендуется проводить женщинам с низким риском РМЖ13.
Исследования свидетельствуют о высокой способности к выявлению новообразований с помощью УЗИ молочных желез. К его недостаткам можно отнести следующие: УЗИ не обладает такой детальностью, как маммография; не позволяет выявлять микрокальцинаты. Кроме того, заключение УЗИ во многом носит субъективный характер, а надежность его результата целиком зависит от опыта и квалификации врача. Преимуществами ультразвукового исследования являются его безопасность и неинвазивность, отсутствие рентгеновского облучения. Однако использование УЗИ вместо маммографии не рекомендуется14.
Достоверно подтвердить или опровергнуть диагноз злокачественного новообразования молочных желез возможно только при морфологическом исследовании состава опухоли. К таким методам относят иммуногистохимическое исследование опухолевой ткани для определения молекулярно-биологического типа рака молочной железы15. Показаниями к тонкоигольной биопсии служат: все сомнительные очаги в ткани молочной железы размерами 0,5 см; кисты размерами более 2 см. При необходимости тонкоигольная пункция выполняется под контролем УЗИ или маммографии6,16. CORE-биопсия является более совершенным и информативным методом морфологической диагностики рака молочной железы. К преимуществам CORE-биопсии можно отнести быстроту ее выполнения, практическое отсутствие дискомфорта. В случае подтверждения диагноза «рак молочной железы» возможно сразу определить степень злокачественности опухоли, рецепторный статус, экспрессию гена HER2/neu, степень пролиферативной активности опухоли15.
Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov. 68 (6):394-424.
International Agency for Research on Cancer. Cancer Today. URL: https://gco.iarc.fr/today/en (Дата обращения: 30.06.2024)
Turnbull C., Rahman N. Genetic predisposition to breast cancer: past, present, and future. Ann Rev Genomics Hum Genet. 2008;9: 321- 345.
Tung N., Lin N.U., Kidd J. et al. Frequency of Germline Mutations in 25 Cancer Susceptibility Genes in a Sequential Series of Patients With Breast Cancer. J Clin Oncol. 2016;34: 1460-1468.
American Cancer Society. Breast cancer facts&figures 2017-2018. Atlanta: American Cancer Society, Inc. 2017.
Рак молочной железы. httрs://www.rоnc.ru/grown/treatment/factors/rak-molochnoy-zhelezy/. Accessed May 11, 2020.
Amin M.B. et al. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging // CA. Cancer J. Clin. 2021. Vol. 67, № 2. P. 93–99
Клинический протокол диагностики и лечения рака молочной железы, №174 от 21 ноября 2022
Oeffinger K.C., Fontham E.T., Etzioni R. et al. Breast Cancer Screening for Women at Average Risk: 2015 Guideline Update From the American Cancer Society. JAMA. 2015;314: 1599-1614.
Friedwald S.M., Raffery E.A., Rose S.L. Breast cancer screening using tomosynthesis in combination with digital mammography. JAMA 311 (24):2499–2507, 2014.
Smith R.A., Saslow D., Sawyer K.A. et al. American Cancer Society guidelines for breast cancer screening: update 2003. CA Cancer J Clin. 2003;53: 141-169.
Breast Cancer Risk Assessment and Screening in Average-Risk Women. ACOG practice Bulletin. Number 179, July 2017.
Saslow D., Boetes C., Burke W. et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin. 2007;57: 75-89.
Tagliafico A.S., Calabrese M., Mariscotti G. et al. Adjunct Screening With Tomosynthesis or Ultrasound in Women With Mammography-Negative Dense Breasts: Interim Report of a Prospective Comparative Trial. J Clin Oncol. 2016.
Core Needle Biopsy of the Breast | Core Needle Biopsy httрs://www.cаncer.org/cancer/breast-cancer/screening-tests-and-early-detection/breast-biopsy/core-needlebiopsy-of-the-breast.html Accessed:11-05-2020.
Fine Needle Aspiration (FNA) Biopsy of the Breast | Breast Aspiration.httрs://www.cаncer.org/cancer/breast-cancer/screening-tests-and-early-detection/breast-biopsy/fineneedle-aspiration-biopsy-of-the-breast.html Accessed:11-05-2020.
